なめこ の 巣 脱臭 岩硫化水素 - Wikipedia. 特徴. 硫化水素は、空気より重く(比重1.1905)、無色、 水 によく溶け、弱い 酸性 を示す。 可燃性ガスであり、 引火性 がある。 爆発限界 は4.3 – 46 %。 燃焼した場合には 硫黄酸化物 となる。 硫化水素は 好気性生物 の多くにとっては有毒であるが、酸素非発生型光合成、すなわち水素源として水ではなく硫化水素を … 詳細. 硫酸と硫化水素の違いは?発生方法・反応式は?水に溶けると . 硫化水素発生方法・反応式は?水に溶けると硫酸? 硫化水素をそのまま水に溶かすと硫化水素酸、HS- とH+に電離する。 硫化水素の水溶液(硫化水素 …. 硫化水素の性質まとめ(中学生用) - 中学理科の苦手解決サイト . 硫化水素(りゅうかすいそ)とは? 意味や使い方 - コトバンク. 水に溶けて弱酸性を示す。 各種金属塩の 水溶液 に通ずると特有の色をもつ硫化物を沈殿させるので、分析試薬として利用。 化学式 H 2 S. 出典 小学館デジタル大辞泉につ …. 【高校化学】「硫化水素の性質」 | 映像授業のTry IT. 硫化水素の性質 水に溶かすと弱酸性. 2つ目の性質は、水に溶かすと 弱酸性 を示すことです。 このときの状態を式で表すと、次のようになります。 H 2 S⇄H + +HS - HS - ⇄H + +S 2- H + が発生しているので、酸性を示すことがわかりますね。 硫化水素の性質 強い還元性. 3つ目は、 …. 硫化水素の安全な取り扱い方法 - J-STAGE. 水は室温で約3倍量(容量)の硫化 水素を吸収する.また多くの炭化水 素に溶けるがアルコールにはほとん ど溶けない. 2・3 主な化学的性質 反応性 濃硝酸発,煙硝酸そ …. 硫化水素. 水中に放置および水と混合時の挙動: 硫化水素は水に溶解する。この溶液上方の空気は爆発の可能性があり、その 場合、硫化水素の強いにおいに気づくようになる。 健康 …. ボール 紙 どこで 売っ てる
コンビニ 凍っ た 飲み物硫化水素水. 硫化水素を水に溶かすと、一段めの電離. H2S ⇀ ↽ H+ + HS−. 及び、二段めの電離. HS− ⇀ ↽ H+ + S2 −. が起こり、水溶液中に、H+、HS−、S2 − が生成することになる。 た …. 第46章 酸素・硫黄の単体と化合物 - Osaka Kyoiku. 硫化水素は水に比較的溶け,水溶液は弱い酸性を示します。水と反応すると,オキソニウムイオンができることで説明できますね。硫化水素が電子を放出すると,硫黄ができます。したがって,硫化水素が酸化されると,溶液は白く濁ります. 【高校無機化学】硫黄(16族)とその化合物(硫化水素、二 . 有毒気体. {H₂S}と {SO₂}の相違性質 {H₂S腐卵臭 水溶液中の金属イオンを硫化物として沈殿. {Cu²+ + S²- CuS v} SO₂刺激臭 {還元性が, 絹・羊毛などの {漂 …. kiramune カンパニー 見る に は
栃木 レモン 牛乳 どこで 買える【定義】水に溶ける(溶解する)とは一体どういう現 …. 水に溶けるという現象は「溶質(イオンや分子)の周りを溶媒分子が囲み、それによって溶質同士が引き離されバラバラになる現象」である。 一方、電離するという現象は「 塩 を構成する 陽イオンと陰イオン が引き離されてバラバラになる現象」である。 「水に溶 …. 質問箱 - Saitama U. 回答 硫化水素の組成式はH 2 Sです.「硫」はイオウSを表しますので,硫化水素はイオウと水素Hの化合物(イオウと化合した水素)と言う意味です.水に溶けると極端 …. 硫化水素を水に溶かすとどう変化しますか?化学式でお願いし . 硫化水素を水に溶かすとどう変化しますか? 化学式でお願いします. 化学 ・ 5,274 閲覧 ・ xmlns="ww.w3.org/2000/svg"> 25. ベストアンサー. …. 硫化物(りゅうかぶつ)とは? 意味や使い方 - コトバンク. 酸性塩は水に溶けるが、正塩は アルカリ金属 の化合物以外はすべて難溶ないし不溶である。 水溶液 は 加水分解 により強いアルカリ性を示す。 重金属の硫化物はすべて難 …. 水に難溶なイオン結晶(水酸化物・硫化物・塩化物・硫酸 . 水溶液の液性によって沈殿生成のしやすさが異なる理由. 硫化物イオンは、水溶液中で次のような平衡状態になっている。. [ begin {align} &mathrm {H_ …. 温泉の化学 「硫黄七変化」 1. - Tohoku University Official . さて、このうち、硫化水素に着目しますと、硫化水素は水に溶けますので、下記のようなイオ ンの解離反応を起こします。 イオンの解離反応とは、食塩が …. 【高校化学】「二酸化硫黄の性質」 | 映像授業のTry IT (トライ . 二酸化硫黄の性質 水に溶けると亜硫酸を生じ、弱い酸性. vba フォルダ 内 の ファイル を 順番 に 開く
虫歯 レントゲン で わかる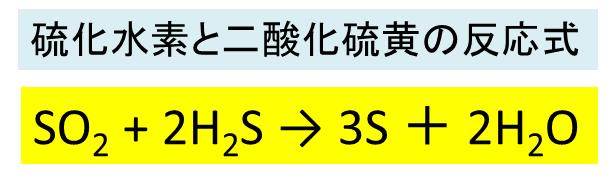
二酸化硫黄を水に溶かすと、 亜硫酸 が生じ、 弱い酸性 を示します。 反応式は、次のようになります。 SO 2 +H …. 硫化水素中毒の防止対策とは?発生原因から対処法まで詳しく解説. ・水に溶けやすい. 温泉地に行ったときに、硫黄の独特な臭いをかいだ経験はありませんでしょうか。 あの臭いは、温泉地の空気中に含まれている硫化水素 …. H2Sは何故水によく溶けるのですか? - 硫化水素H₂Sは水や . ベストアンサー. 静かなオーケストラ さん. 2020/9/29 16:15. 硫化水素H₂Sは水やアンモニアと同じく極性分子と呼ばれるもので、電子の偏りがあります。. 極性分子は極性溶 …. 扁桃 炎 は うつる のか
痛風 について 正しい の は どれ か産総研:メタンハイドレートが分布する海底のメタン動態を評価. 生物組織から抽出される成分のうち、水に溶けずヘキサンなどの有機溶媒に溶ける物質。炭素と水素を主成分とする炭化水素の骨格を持ち、細胞膜を構成する脂肪 …. 硫化水素が水に溶けると何になりますか? - Yahoo!知恵袋. 硫化水素が水に溶けると何になりますか? 化学 ・ 1,897 閲覧. 1人 が共感しています. ベストアンサー. ID非表示 さん. 2014/7/28 0:43. 硫化水素酸、HS- …. 硫化水素(りゅうかすいそ)とは何? わかりやすく解説 Weblio辞書. 硫化水素とは. 硫化水素とは、 硫黄 と 水素 の 無機化合物 のこと。. 化学式 が H2S の 気体 で、 腐った 卵に 似た 臭いを 持ち 、 空気 に 対す る 比重 は1.1905とやや重たい。. 水 に 溶け やすく弱い 酸性 で、 260 度になると 発火する 。. 皮膚 や 粘膜 を . 化学(気体の溶解)|技術情報館「SEKIGIN」|気体の液体 . 一般に溶解といった場合には,固体や液体が液体(溶液)の溶媒に溶ける現象など,容易に視認できる現象をイメージする。 気体が溶媒に溶ける現象は,視認困難であると共に,温度の他に圧力の影響を強く受けるため,液体や固体の溶解とは取扱いが異なる。. H2Sは何故水によく溶けるのですか? - 硫化水素H₂Sは水や . 硫化水素H₂Sは水やアンモニアと同じく極性分子と呼ばれるもので、電子の偏りがあります。 極性分子は極性溶媒によく溶けます。硫化水素は水に溶けます これは水に溶けるという表現は硫化水素がなくなる、という解釈で良いのでしょうか?. 水素は水に溶けない?溶けたとしても少なすぎて意味がない . 水素は水に溶ける. 高温でもわりと溶ける. なぜ「水素は水に溶けない」と思われているのか?. 水素がちょっとだけ溶けたとしても、少量すぎて意味がない?. 1.水に溶ける「水素分子の数」は酸素の約2/3。. そんなに少なくもない。. 2.水素分子が …. 硫化水素(H2S)と水(H2O)の反応式を教えてください。また . 
硫化水素の水に溶ける化学反応式を教えて下さい。 化学 H+は陽子のみですが何か球状の枠みたいなのものがあるのでしょうか? 化学 知人から送られてくるLINEの絵文字が変なのですが… 「いつもすみません⁉ 」とか「ありがとう . 硫化水素ナトリウムを中性の水に溶解すると、その水溶液は . 硫化水素ナトリウムを中性の水に溶解すると、その水溶液は塩基性になるらしいのですがなぜでしょう?硫化水素イオンも加水分解しているのでしょうか? 「HS^-」は両性電解質だから「酸としての強さ」と「塩基としての強さ」を比較すればよい。酸:HS^-⇔H^++S^2-;K=K2塩基:HS^-+H2O⇔H2S+OH . 硫化水素が水に溶けると何になりますか? - Yahoo!知恵袋. 硫化水素が水に溶けると何になりますか? …続きを読む 化学・1,897閲覧 1人が共感しています 共感した ベストアンサー ID非表示 ID非表示 さん 2014/7/28 0:43 硫化水素酸、HS- とH+に電離する。NEW! この回答はいかがでしたか 参考に . 気体の溶け方とは? 圧力・温度と気体の溶解度とは? | 科学を . 下の表は、酸素や水素などの気体が1気圧のときにいろいろな温度の水1キログラムに、どれだけ溶けるかをしめしたものです。 この表で、窒素や酸素などの気体は水1キログラムに、0.1グラムも溶けないことがわかります。. 【高校化学】「二酸化硫黄の性質」 | 映像授業のTry IT (トライ . 二酸化硫黄の性質 通常は還元剤、強い還元剤に対しては酸化剤. 二酸化硫黄は通常 還元剤 としてはたらきます。. しかし、硫化水素のような 強い還元剤 に対しては、 酸化剤 としてはたらきます。. 反応式は、次のようになります。. 2H 2 S+SO 2 →3S+2H 2 O. 
二 . 温泉の化学 「硫黄七変化」 1. 一方、硫化水素は水に溶けることのできる量(溶解度)が温度で決まっていますので、温度が 上がると、硫化水素は出やすいのです。 結局、硫化水素が含まれている温泉では、酸性が強く、温度が高い温泉ほど、臭い、というこ とに . 気体の溶解度(ヘンリーの法則・体積や圧力との関係・計算 . ヘンリーの法則 温度が一定のとき、気体の溶解度はその気体の圧力に比例する。これを ヘンリーの法則 という。 ヘンリーの法則は、水への溶解度が小さい(=水との反応性が小さい)気体において成立する。(アンモニアNH 3 や塩化水素HClなど、水に溶けやすい気体には適用不可). 春休みの宿題で困ってます!;アルゴン・二酸化硫黄・硫化水素 . すぐ ミミズ 腫れ に なる
本 に 関わる 仕事 正社員まず、気体の集め方の選択方法について説明します。 【1】その気体が水に(ほとんど、あまり)溶けないなら水上置換法にする。 ↑水上置換法はほかの気体と混ざる心配がないからです。 【2】水に溶けるなら、その気体が空気より重ければ下方置換法、空気より軽ければ上方置換法にする。. 酸素・硫黄(16族元素):オゾンや硫化水素、硫酸の性質 . なお硫化水素が水に溶けると、一部が電離することで弱酸性を示します。以下のように電離します。 H 2 S HS – + H + HS – S 2-+ H + 硫化水素は弱酸であるため、2段階で電離する性質があります。なお硫化水素の実験的製法に つい . 硫化物(りゅうかぶつ)とは? 意味や使い方 - コトバンク. 硫黄の水素酸すなわち硫化水素酸H 2 Sは二塩基酸なので、金属の硫化物には酸性塩M I HSと正塩M I 2 Sとがある。酸性塩は水に溶けるが、正塩はアルカリ金属の化合物以外はすべて難溶ないし不溶である。水溶液は加水分解により. 水溶性の塩と難溶性の塩 | ねこでもわかる化学. Contents沈殿の生成塩の種類硝酸塩塩化物硫酸塩炭酸塩クロム酸塩 沈殿の生成 イオン結晶は一般的に水に溶けやすい(水和しやすい)ものが多いが、水に溶けにくいものがある。この理由については、単純には言えず様々な面から論 . 化学(実在気体の溶解量)|技術情報館「SEKIGIN」|実用 . 
溶解量 ( g )=気体の体積( mL )×気体の分子量/22414. で得られる。. 大気(窒素,酸素)の溶解量について. 地表付近の大気は, 【混合気体(空気)について】 で紹介したように,乾燥空気の大部分が 窒素 ( 78.084 容量%)と 酸素 ( 20.9476 容量%)で . 硫化銅(りゅうかどう)とは? 意味や使い方 - コトバンク. 水にほとんど溶けないが,アンモニア水にわずかに溶け,シアン化カリウム溶液には容易に溶ける。 銅を硫黄蒸気中で燃焼させるか,硫化銅(Ⅱ)に少量の硫黄を加えて 水素 気流中で400~500℃に熱すると得られる。. 硫黄の単体と化合物の性質・製法 | 化学のグルメ. 参考:酸化剤・還元剤(違い・見分け方・例・一覧など) 重金属イオンと反応し、硫化物の沈殿を形成する H 2 Sは金属イオンと反応し、硫化物の沈殿を形成する。 液性により沈殿を形成する金属イオンが異なることを利用し、金属イオンの分離や分析の試薬として用いられる。. 【高校無機化学】気体の性質まとめ(色・臭い・水溶性・捕集 . また, {C-H}結合は疎水性であるから, 炭化水素の気体は水に溶けにくい(有機化学). その他, 二酸化化合物は水に溶けやすく, 一酸化化合物は溶けにくいという傾向も見て取れる. {CO₂と{Cl₂}は無極性だが, 水に少し溶ける.} {CO₂} {CO₂. 硫化水素水と硫酸って何が違うんですか - 硫化水素水は弱酸性 . ベストアンサー. 他の方の回答にあるとおり、二つは全く別物。. 硫化水素は化学式 H2S で表されるガスで、火山や温泉の「卵の腐った臭い」の元で す。. 質問にあるとおり、水に溶けやすく、その水溶液は弱酸性を示します。. 一方、硫酸は H2SO4 で、常温で . 硫化リン - ゼロからわかる危険物取扱者試験. 硫化リンとは、硫黄とリンが化合した物質です。 物質によって水に溶けるかどうかが異なるので注意してください。どれも燃焼すると有毒ガスを発生します。融点は硫黄元素Sの数が多いほど大きくなります。 また、比重は硫黄元素Sの数が多いほど大きくなるのもポイントです。. 1. 亜鉛の水溶性化合物. なお、亜鉛は硫化鉱などの鉱物として広く産出され、地殻の表層部には重量比で0.004% 程度存在し、クラーク数では31番目に多い元素です。 健康影響(※本項目は、「亜鉛の水溶性化合物」ではなく「亜鉛」として記述します). 製品情報-硫化水素計 | テクネ計測製品情報. 硫化水素計 校正器・加湿装置 制御盤・計測ユニット・流体制御機器 絞り込み検索 . 長期安定に優れた空気環境測定機器をそろえています もいすちゅ〜の水分講座 露点のことや、露点計の原理について解説しています。 酸素濃度計 . 硫化亜鉛(りゅうかあえん)とは? 意味や使い方 - コトバンク. 硫化亜鉛りゅうかあえんzinc sulfide. 亜鉛の硫化物。. 天然には 閃亜鉛鉱 (せんあえんこう)として、またまれにウルツ鉱として産する。. 硫酸亜鉛 水溶液に 硫化アンモニウム を加えるか、酢酸 酸性 亜鉛塩水溶液に硫化水素を通ずると沈殿する。. 無色 の粉末 . 硫化水素が水に溶けると硫化水素酸になるのですか?また . 硫化水素が水に溶けると硫化水素酸になるのですか?また、硫化水素と硫化水素酸の化学式はどちらともH2Sですか? 硫化水素の水溶液を単に「硫化水素酸」と呼べるだけです。つまり、混合物なので化学式で表すというのは間違いです。例えば、塩酸の化学式はHClといえば不正解になります。. 硫化水素による二次被害にご注意ください - 福島県ホームページ. 硫化水素の特徴 空気より重く、無色、水にもよく溶け弱い酸性を示し、腐った卵に似た特徴的な強い刺激臭(腐卵臭とはそもそも硫化水素を主成分とする臭いである)があり、目、皮膚、粘膜を刺激する有毒な気体である。. 高校化学で質問です。硫化水素の水への溶解度は、phに関わら . 高校化学の、溶解度積の問題を教えていただきたいです! 金属イオンを含む水溶液に硫化水素を通すと、硫化物が沈殿することが多い。この沈殿反応は、 金属イオンの確認や分離に用いられる。硫化水素は水に溶解すると、次のような 2 段階の電離平衡 が成立する。. 塩化水素の性質まとめ(中学生用) - 中学理科の苦手解決サイト . 水に溶けると塩酸(酸性) 有毒 このページを読めば、 塩化水素の解説を 画像 や 写真 つきで学習することができるよ . 硫化水素の性質まとめ(中学生用) 2023年10月1日 二酸化硫黄の性質まとめ(中学生用) 2023年10月1日 窒素の性質 . 決算 税理士 に 渡す もの
決裁 を 回す硫化リン(三硫化四リン・五硫化二リン・七硫化四リン)│ . マッチの原料として用いられます。塩素酸カリウム(第1類)と混合したものを硫化リンマッチといいます。 性質 黄色の結晶 比重2.03 発火点:100 、融点:172 、沸点:407 水に溶けず、二硫化炭素およびベンゼンに溶ける 熱水と反応し、硫化水素((ce{H2S}))とリ …. 気体の性質. 空気は主に酸素と窒素でできている。. 芝 の 根 切り 時期
ストレート ネック 上 を 向く と 痛い酸素は空気より少し重く、窒素は少し軽い。. 最も軽い気体は水素で空気に比べて非常に軽い。. 水に溶けるかどうか. 水に溶ける =>二酸化炭素 (少し)、アンモニア、塩化水素、塩素、硫化水素. 水に溶けにくい …. 硫化リン(三硫化四リン・五硫化二リン・七硫化四リン)│ . 
マッチの原料として用いられます。塩素酸カリウム(第1類)と混合したものを硫化リンマッチといいます。 性質 黄色の結晶 比重2.03 発火点:100 、融点:172 、沸点:407 水に溶けず、二硫化炭素およびベンゼンに溶ける 熱水と反応し、硫化水素((ce{H2S}))とリ …. 硫酸と硫化水素の違いとは? - 塩化水素を水に溶かすと塩酸に . 塩化水素を水に溶かすと塩酸になるように 硫化水素を水に溶かすと硫酸になると 考える人がいますが、それは違います。 硫化水素は化学式がH2S 硫酸は化学式がH2SO4です。 つまり性質どころか物質として 全く別物ということになります。. 酸性の硫化水素とアルカリ性の硫化水素とはどのような違いで . 硫化水素の水に溶ける化学反応式を教えて下さい。 化学 原神についてです。 乗っ取られたアカウントを取り戻す為に 原神のお問い合わせしたんですけど、 運営から返ってきたメールが アカウントの譲渡、第三者に原石を使わせて . なぜ塩素Cl2は水に溶けやすく、ヨウ素I2は水に溶けにくいの . 塩素は酸化力が強くて水と反応する 塩素Cl 2 も ヨウ素I 2 もハロゲンの単体で無極性分子です。 しかし、塩素は水に溶けやすく、ヨウ素は水に溶けづらいという違いがあります。これはなぜしょう。 ハロゲンの酸化力(電子を奪う力)は、 F>Cl>Br>I と周期順です。. 高校化学 亜鉛 - Wikibooks. 亜鉛 [編集] 亜鉛 Zn は周期表12族の元素であり、原子は価電子を2個もち、2価の陽イオンになりやすい。 亜鉛の単体は、銀白色の金属である。 亜鉛は両性元素であり、酸とも塩基とも反応して水素を発生する。たとえば塩酸と水素を発生しながら反応して塩化亜鉛に …. 二硫化炭素 - Wikipedia. 二硫化炭素(にりゅうかたんそ、英: carbon disulfide )は代表的な炭素の硫化物で、化学式は CS 2。 無色で 揮発 性の 液体 であり、主に セロハン や レーヨン の製造過程で 溶剤 として利用されているほか、 ゴム の 加硫 促進剤、 有機化学 原料や 浮遊選鉱 剤などに用いられている。. 高校化学 鉛 - Wikibooks. 鉛 [編集] 鉛 鉛 Pb は青白色のやわらかい金属である。 鉛とその化合物は有毒である。 鉛は、両性元素であり、硝酸、強塩基の水溶液と反応して溶ける。しかし、塩酸と希薄硫酸には、鉛の表面に難溶性の皮膜(塩化鉛 PbCl 2 や、硫酸鉛 PbSO 4 の皮膜は、水に難溶)が発生するため、溶けない。. 塩素の性質まとめ(中学生用) - 中学理科の苦手解決サイト . 水に溶けると酸性 有毒 このページを読めば、 塩素の解説を写真や動画付きで学習することができるよ . 硫化水素の性質まとめ(中学生用) 2023年10月1日 二酸化硫黄の性質まとめ(中学生用) 2023年10月1日 窒素の性質まとめ(中学生用) . 二酸化硫黄と硫化水素の関係 -まず始めに、私は化学初級者なの . > 両者とも水に溶けるのですか? 溶けます。硫化水素はそのまま溶け,二酸化硫黄は溶けて亜硫酸になります。 > 両者に直接的なつながりはないということでよろしいのでしょうか。 ku-che さんの質問の背景がわからないと,ある . 気体の水溶性と気体の収集方法(上方置換、下方置換、水上 . 上方置換法の原理と上方置換によって集めることができる気体. 基本的に上方置換方法で収集できるとは、空気よりも密度が小さい物質です。. ただ、すべての気体の密度を覚えておくということは現実的ではないです。. そのため、空気との分子量(約28.8 . 硫化水素の2段階電離と硫化物沈殿におけるpHの影響 - 受験の月. 定期試験・大学入試に特化した問題・解説、暗記事項まとめ。電離定数の関係K=K₁K₂を導く。 金属イオンの硫化物沈殿が酸性条件と中性・塩基性条件で変化することやそれを利用して金属イオンを分離することは無機化学で詳しく学習する。. 硫化水素中毒の防止対策とは?発生原因から対処法まで詳しく解説. 本記事は、硫化水素中毒の防止対策について解説した記事です。硫化水素中毒が発生するメカニズムを解説し、防止対策を詳しく紹介します。硫化水素中毒が発生したときの注意点や酸素欠乏症についても言及しているので、作業現場の安全確保を担っている方のお役に立つ内容です。. 理科ネタ【水に溶けるってどういうこと?】 | 中学理科 . 3.水に溶けるとは 塩化ナトリウムNaClが水に溶けることを考えましょう。塩化ナトリウムNaClはナトリウムイオンNa + と塩化物イオンCl - が結びついてできた物質です。 これを水に入れると・・・ 水分子H 2 Oのうち水素原子Hは+にかたより、酸素原子Oは-にかたよっていました。. なぜNa2Sは水に溶けるのですか? (+ 他に知っておくべき 3 つの . 正の水素原子は負に帯電した硫化物イオン (S)2- に引き寄せられ、負の酸素原子は正に帯電したナトリウム イオン (Na+) に引き寄せられます。 水分子とナトリウムおよび硫化物イオンの間のこれらの引力は、 イオン双極子相互作用 として知られて …. 「溶ける銀?沈殿する銀?」銀の溶解、沈殿、銀化合物の性質に . 本記事では、銀の溶解、沈殿と生成物の性質について詳しく解説しています。この記事を読むと、銀の反応や銀化合物の特徴に関する知識を得ることができます。また、銀錯体の電子配置やハロゲン化銀が水に溶けにくい理由を理解することができま …. 火山ガス・エアロゾルのガイドライン 硫化水素(H2S) | IVHHN. 火山における事例. 硫化水素 (H2S)は、地熱地帯や温泉地帯同様、噴気の近くや火口で危険な濃度が見つかっています (Baxter, 2000)。. 火山では、噴気ガスの混合物の中では、低いレベルの場合であっても、H2Sの臭いが感知できないので、 労働者はH2Sについて . 硫酸って硫化水素が水に溶けたものではないんですか?塩酸が . 2 回答. 硫酸って硫化水素が水に溶けたものではないんですか?. 塩酸が塩化水素が溶けたものなので名前的にそう考えてしまいました。. ただよくよく考えると硫酸はH2SO4、硫化水素はH2Sで全く別物なんですよね…?. イマイチすっきりしないのでどなたかご . なぜNaClは水に溶けるの? | ねこでもわかる化学. なぜNaClは水に溶けるの?. 荼毘 に 付す こと が でき まし た
食べ物 を 噛む と 歯 が 痛い
NaClはNa + とCl – のそれぞれのイオンが クーロン力(静電気力) によって結合しています。. これを水のような強い極性溶媒中に入れると、結晶中に働く静電気力が分散されてしまい、お互いの結合が緩くなります。. そ …. 硫化リン - Wikipedia. 硫化リン(りゅうかリン)は、リンと硫黄の化合物の総称。 P x S y で表される。 発火しやすく危険物第2類(可燃性固体)に指定されている。 水と反応すると硫化水素 H 2 S を発生する。 三硫化リン (P 4 S 3)、五硫化リン (P 2 S 5)、七硫化リン (P 4 S 7) があり、いずれも常温では淡黄色の固体である。. Journal of Japanese Biochemical Society 87(2): 218-220 (2015). 3. 生理活性物質としての硫化水素 硫化水素は,気体としてのイメージが強いが,水や油によく溶ける性質がある.記憶と学習の生理モデルとして海馬の長期増強があるが,海馬スライスの培養液に硫化水素を添加すると長期増強の誘導が促進されることが1996年に初めて報じられた 2) .翌1997年 . 化学(硫化物)|技術情報館「SEKIGIN」|硫黄化合物の中で . 硫黄の水素酸すなわち硫化水素( H 2 S )は二塩基酸なので,金属の硫化物には酸性塩( MHS )と正塩( M 2 S )とがある。酸性塩は水に溶けるが,正塩はアルカリ金属元素の化合物以外は水に対し難溶(不溶)である。. 鉛の性質と用途とは? わかりやすく解説! | 科学をわかり . 元素 水は水素と酸素とに分解されますが水素や酸素はどのような科学的方法を使ってもほかの物に分解することはできません。 水素や酸素のように、いろいろな物のもとになりそれ以上は決して分解されないような物を元素といいます。. 気体の発生と性質 ~気体の種類やそれぞれの性質・発生の方法 . 水への溶解性:非常によく溶ける(水溶液はアルカリ性) 窒素 色:無色 におい:無臭 水への溶解性:溶けにくい 体積の割合で空気の約78%を占める。 塩化水素 水への溶解性:非常によく溶けて、水溶液は強い酸性を示す(塩酸)。 塩素. 硫化水素 - fdma.go.jp. 小食 に なる 方法
も も クロ 黄 変わっ た
主成分 含有率 状態 気体 爆発範囲 4.3~46 vol%(空気中) 色 無色 比重 0.96(水=1) 臭気 特徴臭 蒸気比重 1.19 引火点 融点 -85 発火点 260 水溶性 室温では1Lの水に約3L溶ける。弱い二基塩酸で酸性を呈する。その. 硫化鉄(りゅうかてつ)とは? 意味や使い方 - コトバンク. 水に難溶。酸には硫化水素を放って溶ける。天然には磁硫鉄鉱として産。隕鉄(いんてつ)中にトロイライトとしても存在。工業的には硫黄と鉄粉とをるつぼ中で融解してつくり,硫化水素発生に用いる。(2)硫化鉄(III)Fe 2 S 3 比重4.3. 金属イオンの分離:色や沈殿、試薬との反応を解説 | Hatsudy . もくじ 1 試薬と反応させ、金属イオンを分離する 1.1 金属と塩基(アンモニア水、水酸化ナトリウム)との反応 2 金属イオンを実際に分離してみる 2.1 塩酸HClを加える:銀イオンと鉛イオンの沈殿 2.2 酸性条件で硫化水素H2Sを加える 2.3 過剰のアンモニア水を加え、水酸化物と錯イオンを作る. 硫化ナトリウム(りゅうかナトリウム)とは? 意味や使い方 . 水に溶け、エタノール(エチルアルコール)にわずかに溶けるがエーテルには不溶。水溶液は強アルカリ性を呈し、硫黄を溶解して黄色のポリ硫化ナトリウムNa 2 S x (xは2、3、4、5)を生成する。酸を加えると硫化水素を発生する。硫化. 気体の性質 - 中学理科のまとめ. 二酸化炭素・・・石灰水を白くにごらせる。水に溶けると酸性の 炭酸水 となる。 水素・・・気体自身が燃えるはたらき( 可燃性 )をもっている。 塩化水素・・・水に とけることで 塩酸 となる。 塩素・・・消毒や殺菌の作用がある . 悪臭物質ガスの水への溶解度† 村上英樹*・岡田達治・新田 …. 会 いたい 人 に 会える 待ち受け
(アンモニア,ト リメチルアミン,硫化水素,メ チルメ ルカプタン,硫 化メチル)と 昭和51年に追加された3物 質(二 硫化メチル,ア セトアルデヒド,スチレン)で あ る.こ のうちアンモニアおよび硫化水素の水への溶解度. 塩の水への溶解性まとめ | ねこでもわかる化学. 塩の溶解性まとめ 以上のことをまとめると、塩の水への溶解性は次のように整理することができる。 ①よく溶ける塩 1族の塩、アンモニウム塩、硝酸塩、酢酸塩は水によく溶ける。 ②塩化物 塩化物は水に溶けやすいものが多いが、AgCl、PbCl 2 、Hg 2 Cl 2 (いずれも白色)は水に溶けない。.






